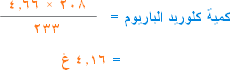|
 |
||||||||
 |
الدرس السادس
مسألة محلولة (1) صفحة 158 المعطيات : * كمية محلول كلوريد الباريوم = 200 سم3 (مل) * كمية محلول كبريتات النحاس كافية لإتمام التفاعل . * تنتج مادة راسبة (ملحاً) كتلتها صافية نقية = 4.66 غ .
المطلوب : 1) كتابة معادلة التفاعل الموزونة جزيئياً . 2) كتابة معادلة بشكل شاردي (معادلة أيونية) وموزونة . 3) حساب كتلة كلوريد الباريوم التي تفاعلت . 4) حساب تركيز محلول كلوريد الباريوم مقدراً بالغرام / لتر (غ / ل)
تحليل السؤال : التغير الحادث يمكن أن نمثله كتابة كما يلي : كلوريد الباريوم + كبريتات الصوديوم ¬ كبريتات الباريوم (غير ذوابة) + كلوريد الصوديوم ويمكن أن نعبر عن ذلك بمعادلة جزيئية موزونة كما يلي :
أما المعادلة الأيونية فهي :
تفيدنا المعادلة الجزيئية في أن مولاً من كلوريد الباريوم ينتج مولاً من كبريتات الباريوم . ولكن كم وزن المول من كلوريد الباريوم Ba Cl2 وزن المول = (1 × 137) + (2 × 35.5) = 137 + 71 = 208 غم
وكم وزن المول من كبريتات الباريوم إنه = (1 × 137) + (1 × 32) + (4 × 16) = 137 + 32 + 64 = 233 غم
إذن عندما تتفاعل 208غ كلوريد باريوم (مول واحد) ينتج 233غ كبريتات باريوم (مول واحد) . كم يتفاعل ؟؟؟؟؟ كلوريد باريوم لإنتاج 4.66غ كبريتات باريوم .
لحساب التركيز نقول أن 4.16 غ كلوريد باريوم موجودة في 200سم3 من المحلول ، كم كمية كلوريد الباريوم في لتر من هذا المحلول .
|
||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||