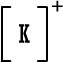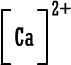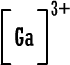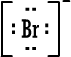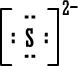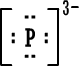|
|||||||||||||||||||||||||||||||||||||||||||||
التقويم :
لأن مدارها الخارجي ممتليء بثمانية الكترونات ومن الصعب الإضافة إليه أو السحب منه (الهيليوم مداره الخارجي هو الأول وهو ممتليء بالكترونين . ويمكن اعتباره أصل قاعدة الثنائي) .
من الأسهل عليها تكوين روابط مشتركة حيث تبقى محاطة بعدد زوجي من الإلكترونات ومستقرة ، تكوين الروابط الأيونية يستدعي كسب أو خسارة الكترونات وهذا يسبب خللاً كبيراً لاستقرار الذرات .
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||||||||||||||||||||||||||||||||||