|
قوانين
الديناميكا الحرارية Laws of thermodynamics
المحتوى الحراري أو
الإنثالبي Heat Content or Enthalpy
7- المعادلة الكيميائية
الحرارية Thermo chemical Equation
هي معادلة كيميائية موزونة مع تحديد
التغير في المحتوى الحراري مقاساً بالكيلوجول .
مثال :
|
 |
النظامية للتفاعل = ـ 250.1
كيلوجول . |
DHْهْ |
إذن التفاعل طارد للحرارة .
عند كتابة معادلة كيميائية حرارية نراعي
ما يلي :
1- عدد المولات في المعادلة والتي تشير إليها أرقام
التوازن .
2-
كتابة حالة المادة في التفاعل لأن المحتوى الحراري للمادة تابع
لحالتها .
مثال :
|
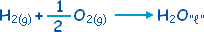 |
ْH
Dه=
ـ
285.3
كيلوجول . |
|
 |
ْH
Dه=
ـ
241.8
كيلوجول . |
3- حيث أن المحتوى الحراري تابع لدرجة
الحرارة فيجب ذكرها في المعادلة , إذا كانت غير الدرجة المتفق
عليها وهي 25 ْ م ( حوالي 298 ْ مطلقة أو كلفن ).
4- عند كتابة المعادلة الكيميائية
الحرارية يمكن وضع كمية الحرارة مع المواد المتفاعلة أو
الناتجة ، ولكن العلماء اتفقوا على أن يكتب المحتوى الحراري
بقرب المعادلة وبشكل مستقل .
 |
مثال (1) : |
التفاعل طارد للحرارة فالحرارة هي أحد
النواتج .
هذه طريقة مقبولة ولكن الاتفاق هو :
ْH
Dه=
ـ
726
كيلوجول
( التفاعل طارد للحرارة والإشارة السالبة تشير إلى ذلك ).
 |
مثال (2) : |
التفاعل ماص للحرارة فالحرارة هي أحد
المتفاعلات .
ْH
Dه=
+
227
كيلوجول
كيلو جول والإشارة ( + ) تشير إلى أن التفاعل ماص للحرارة .
رجوع
|

