ز- يتضح من الشكل أعلاه جميع الروابط هي من نوع سكما وأن وجود الإلكترونين المزدوجين وغير المرتبطتين على الفك
sp3 الرابع يكمل رباعي الأوجه المنتظم. يسمى زوج الإلكترونات
غير المرتبط باسم "الزوج الطليق" .
دراسة جزيء الماء H2O
الذرة المركزية في الماء هي ذرة الاوكسيجين وتوزيعها الإلكتروني
هو
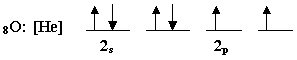
يحدث تهجين sp3 في هذه الذرة وينتج أربع مدارات
هجينة , وهذا هو توزيع الإلكترونات فيها :
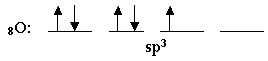
يحدث الترابط بين
ذرتي الهيدروجين وفلكي sp3 اللذين يحويان الإلكترونين المنفردين, أما الفلكان الآخران فهما
ممتلئين , إذن يوجد في جزء الماء زوجان طليقان من الإلكترونات
. يفسر هذا واقع جزيء الماء وهو زاوي الشكل وزاوية الربط فيه
حوالي o104.5 , وهو حالة خاصة أيضا , أما
إذا أخذنا الزوجين الطليقين بعين الاعتبار فالشكل هو رباعي
الأوجه المنتظم لمعرفة شكل جزيء الماء (انظر الشكل ) .
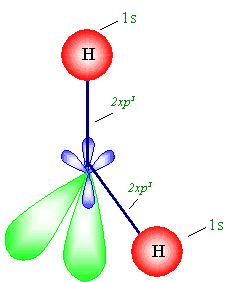
من الواضح أن الروابط من نوع سكما .
سؤال (1)
: اضرب ثلاثة أمثلة لمركبات يحدث فيها تهجين sp3 .
(2)
: لماذا تختلف الزاوية بين مركب وآخر من تلك التي يوجد في ذرتها
المركزية تهجين من نوع sp3 .
2- تهجين sp2
مثال (1) : لندرس الآن جزيء فلوريد البورون BF3 ولنجب عن الأسئلة التالية
أ- ما هو التوزيع الإلكتروني لذرة البورون (الذرة المركزية) :
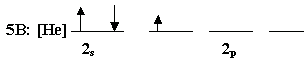
ب- من الواضح أن عدد الإلكترونات
المنفردة في هذا التوزيع هو إلكترون واحد . إذن من المتوقع
أن يكون البورون مركبات يكون فيها أحادي الذرية , ولكنه لا
يشكل هذا النوع من المركبات , بل إن مركباته ثلاثية الذرية
كما يتضح من المثال المعطى BF3 . إذن لابد أفلاكه تحوي ثلاث إلكترونات منفردة .
ج- ما التهجين الذي يحدث في ذرة البورون ؟
إن الأفلاك المهجنة هي أفلاك p,s ويحدث التهجين بين فلك s واثنين من أفلاك p الثلاثة , ويبقى فلك p الثالث دون تهجين , وهكذا يصبح التوزيع الإلكتروني
لذرة البورون المهجنة هو





