الكهروسلبية
وقطبية الرابطة
من الطبيعي أن تختلف ذرات العناصر المعروفة في قدرتها على جذب
الإلكترونات عندما ترتبط الواحدة منها بالأخرى برابطة مشتركة
. وسيظهر هذا الاختلاف في الكثير من الروابط التي تجمع بين
ذرتين من نوعين مختلفين , لنأخذ على سبيل المثال جزيء غاز
HCl , حيث الرابطة المشتركة بين الهيدروجين
والكلور , ودراسة خواص هذا المركب تبين لنا أن الكلور يحمل
شحنة سالبة صغيرة , ويحمل الهيدروجين شحنة موجبة صغيرة . تدل
هذه الخاصية على أن إلكتروني الربط أقرب إلى ذرة الكلور منها
إلى ذرة الهيدروجين ,
وهذا يدل على أن رغبة وقدرة ذرة الكلور على جذب إلكتروني الرابطة
المشتركة أكبر من تلك التي لذرة الهيدروجين .
لنأخذ مثالا آخر
هو غاز أول اوكسيد الكربون CO , والربط فيه C= ?: , هنا نجد أن إلكترونات الربط تميل نحو الاوكسيجين لأنه أقدر
على جذبها من ذرة الكربون . ينطبق الكلام نفسه على الكثير
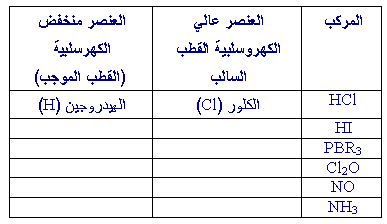
من المركبات مثل PBr3 , HI2 , Cl2O وغيرها .
تدعى قدرة الذرة
على جذب الإلكترونات في الرابطة المشتركة لنفسها باسم الكهروسلبية
. تختلف الكهروسلبية من عنصر لآخر فإذا كانت القدرة على جذب
الإلكترونات كبيرة كانت الذرة عالية الكهروسلبية , وإذا كانت
هذه القدرة منخفضة كانت الذرة قليلة الكهروسلبية .
تدعى المركبات مثل
HCl , و CO , و HI ومثيلاتها باسم المركبات القطبية ذلك لأن للواحد منها قطبان :
قطب سالب (هو الكلور في حالة HCl) وقطب موجب (هو الهيدروجين في مثال HCl) .
تدريب : بالاستعانة بالأمثلة السابقة وبالاستعانة بالشكل أجب عن الأسئلة التالية :
1) أيهما أعلى في كهروسلبية
وبالتالي يشكل القطب السالب في كل مركب من المركبات التالية
:
1- املأ الفراغات في الجدول التالي :
2- لماذا لا توجد قطبية في الجزيئات التالية
أ- H2 ب- N2 ج-CO2 د- CH4 هـ- He .
3- اكتب اسم ورمز العنصر الأعلى في كهروسلبية في الجدول الدوري ,
حدد أيضا موقعه في هذا الجدول .
4- كرر السؤال السابق على العنصر الأقل في كهر وسلبيته .
5- ادرس عناصر الدورة الثالثة ولا خط تغير الكهروسلبية بين عنصر وآخر
فيها , كرر العمل نفسه على الدورة الرابعة والخامسة . ما العلاقة
التي يمكن أن تربط بين كهروسلبية العنصر وموقعه في الجدول
الدوري ؟
6- ادرس قيم كهروسلبية العناصر في المجموعات التالية :
أ- المجموعة الأولى (A) . ب- المجموعة الثانية (A)
ج- المجموعة السادسة A .
ما العلاقة التي يمن أن نستنتجها (إن وجدت قاعدة) على الربط بين
قيمة الكهروسلبية العنصر وموقعه في المجموعة ؟
7- طبق العلاقة (إن وجدت علاقة) التي وجدتها في السؤال السابق
على المجموعات التالية , إذا انطبقت فهذا يدعم صحة العلاقة
, أما إذا لم تنطبق فحاول إعطاء تفسير لعدم الانطباق.
أ- المجموعة VII A ب-
المجموعة V A
ج- المجموعة IVA د-
المجموعة III A
ه- المجموعة IV B و-
المجموعة VII B
ز- المجموعة III B ح-
المجموعة VIII B
8-أكمل الفراغات في العبارات التالية بوضح كلمة واحدة في الفراغ
الواحد .





