مسائــل
|
ملاحظات :
ثابت بلانك (هـ) = 6.63 × 10-34 جول
. ث
سرعة الضوء في الفراغ = 3 × 10 8
م/ث
ثابت رابيرغ (A) = ن2.18 × 10 -18 جول/ذرة
الاعداد الذرية والكتل المولية للعناصر يستخرجها
الطالب من الجدول الدوري للعناصر .
|
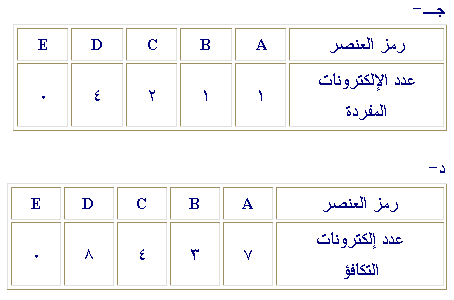
س1- خمسة عناصر رموزها E , D , C , B , A
واعداها
الذرية هي: 17، 13، 32، 26، 18 على الترتيب.
أ-
اكتب التركيب الإلكتروني لكل منها.
ب-أيها
فلز، لا فلز، شبه فلز، نبيل، انتقالي؟
ج-
ما عدد الإلكترونات المفردة في ذرة كل منها؟
د-
ما عدد إلكترونات التكافؤ في ذرة كل منها؟
هـ-
ما صيغة المركب الناتج عن اتحاد العنصرين B , A ؟
الجواب
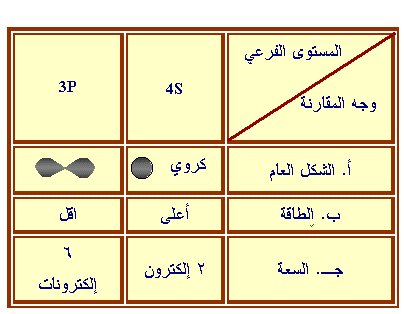
س2- قارن بين المستويين الفرعيين i3P , 4S من حيث:
أ-
الشكل
العام لكل منهما
ب-الطاقة
ج-
السعة القصوى من الإلكترونات
الجواب
س3- إذا كانت طاقة أحد المستويات في ذرة الهيدروجين
تساوي
(-0.545 × 10-18) جول/ذرة.
أ-
ما عدد الكم الرئيس لذلك المستوى ؟
ب-
ما عدد وما نوع المستويات الفرعية في ذلك المستوى الرئيس؟
ج-
ما عدد أفلاك المستوى الرئيس المذكور ؟
د-
ما السعة القصوى من الإلكترونات في هذا المستوى؟
الجواب
س4- ما عدد التغيرات الممكنة في الطاقة لدى عودة
الإلكترون في ذرة هيدروجين مثارة من المستوى n = 6 الى
المستوى n = 1؟
الجواب
س5- إذا كان ترتيب الإلكترون الأخير في ذرة العنصر
(X)
هو الرابع في المستوى الفرعي i3P.
1-
اكتب
التركيب الإلكتروني للعنصر (X)
2-
هل
العنصر (X)
فلز أم لا فلز؟ ما عدده الذري؟
الجواب
س6- إذا كان طول موجة الضوء المنبعث من ذرة هيدروجين
مثارة لدى عودة الإلكترون من المستوى n = 5 الى المستوىn = (X) يساوي
434 نانوميتر فما قيمة (X)؟
الجواب
س7- ماذا يعني وجود مناطق معتمة بين خطوط طيف ذرة
الهيدروجين الخطي؟
الجواب
س8- أيهما أكبر تردد، الضوء المنبعث من ذرة هيدروجين
مثارة لدى عودته من المستوى الرئيسي n= 5 الى n=2 أم لدى عودته من n = 4 الى
n =2؟
الجواب
س9- اكتب التراكيب الإلكترونية للأيونات: i16S-2 26Fe+3 17Cl-1
الجواب
س10- مستخدماً المخطط السهمي اكتب التركيب الإلكتروني
لعنصر عدده الذري 82.
الجواب
-----------------------------
إجابات الأسئلة الخاصة بمادة الفصل الأول
:
17A
: [Ne] 3S2 3P5
13B : [Ne] 3S2 3P1
32C
: [Ar] 3d10 4s4P1
26D
: [Ar] 3d6 4s2
18E
: [Ne] 3S2 3P6
ب – A
=
لا فلز B =
فلز C = شبه فلز
D = انتقالي E = نبيل
E = D,
B فلزان ( في المستوى الرئيس الأخير 3 ، 2 إلكترون
على الترتيب)
هـ - BA3
رجوع
س2 :
رجوع
س3 :
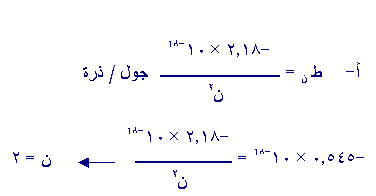
ب-
يوجد مستويان فرعيان هما د
، أ
جـ- 4 أفلاك (واحد من نوع
(د) ، وثلاثة من نوع أ)
د-
السعة القصوى من الإلكترونات 2ن2 = 2 ×
2 2 = 8 إلكترونات
ملاحظة
: 1- عدد الأفلاك في المستوى الرئيس n هو n2
2-
عدد الإلكترونات التي يتسع لها المستوى الرئيس n هو 2n2
رجوع
س4 :
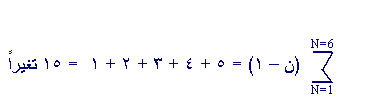
رجوع
س5 :
أ- X = 1S2 2S2 2P6
3S2 3P4
ب-
لا فلز (في المستوى الأخير إلكترونات)
وعدده
الذري 16
رجوع
س6 :

رجوع
س7 : إن المناطق المعتمة توافق ضوءاً ذا أطوال
موجية لم يصدرها العنصر .
رجوع
س8 :
في حالة n
= 5
¬ n = 2
فرق
الطاقة بين المستويين الخامس والثاني اكبر من فرق الطاقة بين
المستويين الرابع والثاني .
وذل
بالرجوع إلى مخطط مستويات الطاقة في ذرة الهيدروجين
ويما
أن D ط a ت (حيث D ط =
هـ ت)
...
يكون التردد المنبعث اكبر لدى عودة الالكترون من المستوى الخامس
الى المستوى الثاني .
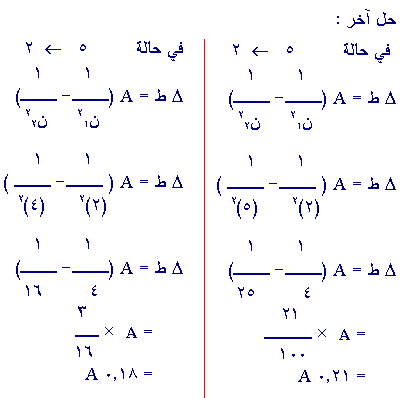
0.21 A >
0.18 A
إذاً D ط 5 ¬ 2 >
D ط 4 ¬ 2
وبما
أن D ط a ت
إذاً
التردد المنبعث اكبر في حالة عودة الالكترون من المستوى الخامس
الى الثاني
رجوع
س9 : ملاحظة : نكتب التركيب الالكتروني للذرة
المتعادلة اولا ثم نضيف الالكترونات للايون السالب او ننزع من
المستوى الاخير في حالة الايون الموجب .
17Cl- :
1S2 2S2 2P6 3S2 3P6
26Fe+3 : 1S2 2S2 2P6 3S2 3P6
4S2 3d3
16S-2 : 1S2 2P2 2P6 3S2 3P6
رجوع
س10 :
6S2 4f14
5d10 6P2 1S2 2S2 2P6 3S2
3P6 4S2 3d10 4P6
5S2 4d10
رجوع





