تدريب (1)
أ) 1- الدورة الرابعة لأن أكبر رقم لِ n = 4
2- الدورة الرابعة .
3- الدورة الرابعة .
4- الدورة الخامسة أكبر رقم ل ِ n =5
5- الدورة الخامسة .
6- الدورة السادسة لأن أكبر رقم لِ n =6
7- الدورة الرابعة .
ب) العناصر هي : 1 , 3 , 5
ج ) 2 , 4 , 6 , 7
د ) عناصر مجموعات A توجد الإلكترونات في المستويات الفرعية
s أو p+s أما عناصر مجموعات B فإن الإلكترونات توجد على المستويات الفرعية
الداخلية d أو f إضافة للمستويات الفرعية s الخارجية (رقم n لها أعلى من
رقم d أو f) .
هـ) في هذه المجموعات تبدأ الأفلاك الخارجية بالامتلاء قبل الأفلاك
الفرعية
الداخلية .
تدريب (2)
أ- 19 : [Ne] 3s2 3p6 4s1 الدورة الرابعة والمجموعة A1 .
ب- i5s : [kr] 4d10 5s2 5p4 الدورة الخامسة والمجموعة VI A .
ج- 56 : [Xe] 6s2 الدورة السادسة والمجموعة
II A .
د- 42 : kr] 4d5 5s1 الدورة الخامسة والمجموعة الانتقالية السادسة
VI B .
هـ- 76 : [Xe] 4f14 5d6 6s2 الدورة السادسة والمجموعة الانتقالية
VIII B أي
هو من الثلاثيات .
و- 63 : [Xe] 4f7 5d0 6s2 الدورة السادسة والمجموعة الانتقالية وهو
من العناصر الانتقالية الداخلية ومن مجموعة اللانثانوم .
تدريب (3)
أ- العدد الذري (12). الدورة الثالثة . المجموعة II A .
ب-[Ne] 3s2 3p6 . العدد الذري (i18) . الدورة الثالثة . المجموعة الثامنة
(مجموعة الغازات النبيلة )VIII A .

د - [Kr] 4d10 5s2 5p2 العدد الذري ( i50). المجموعة IV A .
الدورة الخامسة.
هـ- [Xe] 4f14 5d10 6s2 6p1 العدد الذري (i81) . الدورة السادسة .
المجموعة III A
تدريب (4)
أ- سبعة .
ب- سبعة .
ج- i113X : [Rn] 5f14 6d10 7s2 7p1 الدورة : السابعة . المجموعة IIIA
تغير الحجم الذري :
أ- في نفس الدورة : ينقص الحجم الذري كلما اتجهنا من اليسار إلى
اليمين أي
كلما ازداد العدد الذري .
ب-يتغير الحجم الذري في نفس المجموعة كما يلي : يزداد الحجم الذري
كلما
زاد العدد الذري .
سؤال (1) : شحنة النواة الفعالة هي : للكبريت (i6)
للألومينوم (i3)
للمغنيسوم (i3)
للكلور (i7)
للصوديوم (i1)
1- الصوديوم 2- المغنيسيوم
3- الألومينوم 4- الكبريت
5- الكبريت .
ملاحظة : اكتب التوزيع الإلكتروني لكل عنصر منها لتعرف شحنة النواة
الفعالة .
2- كلما زادت شحنة النواة الفعالة كلما نقص الحجم الذري .
سؤال (3) : حجم ذرة البوتاسيوم أكبر من حجم ذرة الصوديوم فعل الرغم من
تساويهما في شحنة النواة الفعالة إلا أن رقم الكم الرئيس الأعلى
في حالة الصوديوم هو (3) وفي حالة البوتاسيوم (4) .
2- حجوم الأيونات
أ- حجم Ca أكبر من حجم Ca+2 بعد فقد إلكتروني المستوى الخارجي
الأخير (إلكتروني i4s2 في المستوى الرابع ) .
ب-حجم Br-1 أكبر من حجم Br , الأيون يكسب إلكترون إضافي فيزداد
التنافس الإلكتروني ويكبر الجسم .
- تدريب : أ) O -2 ب) N -3 ج) S -2
نفس التفسير مع Br -1 .
سؤال :
من الأصغر إلى الأكبر
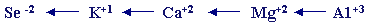
الألومينوم والمغنيسيوم في نفس الدورة والعناصر الثلاثة الأخرى
في نفس
الدورة (الدورة الرابعة ) .
- أكمل الفراغات في الجمل التالية
1- حجم
2- المجموعة 3- الدورة 4- الهيليوم
5- السيزيوم 6- لافلزي .
طاقة التأين :
1- لأن حجم ذرة الصوديوم أكبر من حجم ذرة مغنيسيوم
.
2- الإلكترون الثاني في ذرة المغنيسيوم هو إلكترون خارجي . بين الإلكترون
في ذرة الصوديوم هو إلكترون داخلي
.
3- كالسابق : إلكترون الألومينوم خارجي والمغنيسيوم داخلي .
4- عملية انتزاع الإلكترون الرابع من الألومينوم صعبة جدا وتحتاج
إلى طاقة
كبيرة لأنه إلكترون داخلي .
- استخدام الجدول (1-4) في الإجابة عما يلي :
1- الإلكترون الخامس داخلي .
2- الإلكترونات الستة الأبعد في الكبريت هي إلكترونات
خارجية .
3- لأن عدد الإلكترونات الخارجية في ذرته (i5) إلكترونات وهذا ما يجعله
أميل لكسب الإلكترونات
او تكوين روابط مشتركة .
العناصر الانتقالية
سؤال (1) :
أ - الحديد - النحاس - الخارصين - الفضة - الذهب - وغيرها
.
ب-
كل العناصر في أ- أعلاه إضافية إلى
النيكل - الكوبالت -
المنغنيز - الكروم - البلاتين - الزئبق
وغيرها .
ج- كل العناصر في أ- و ب- والتغستون - الفاناديوم - التيتانيوم
سؤال (2) : تقع العناصر الانتقالية في منتصف الجدول الدوري بين المجموعة
IIA والمجموعة III A .
سؤال (3) : i72
سؤال (4) : i104
سؤال (5) : تقع تحت الجدول الدوري في سطرين منفردين , وتعرف باسم
العناصر الانتقالية الداخلية. تدخل الإلكترونات هنـا في فلك
f
الفرعي وهذا هو سبب تسميتها بالعناصر الانتقالية الداخليJة
,
فالفلك i4f يبدأ باستقبال الإلكترونات بعد الفلك i6s , والفلك i5f
بعد الفلك i7s .
سؤال (7) : أ- i32Ge . 31Ga . 12Mg . 11Na
ب-
بقية العناصر في السؤال .
ت-i26Fe . 25Mn
د-i66Dy 65Tb
هـ-
المجموعة IVA عدد الإلكترونات i4s2 4p2 هو الذي
يحدد المجموعة .
و- الاختلاف الرئيس هو أن في العناصر الانتقالية
تدخل
إلكترونات المستويات الخارجية في أفلاك داخلية من نوع
d و f . أما العناصر الممثلة فتكون هذه الأفلاك
فيها غير
موجودة (نظريا) أو ممتلئة .
ز- المجموعات II A , I A زرقاء . والمجموعات III A إلى
VIII A زهرية اللون .
2- العناصر الانتقالية في الدورات من 6-4 صفراء اللون . العناصر
الانتقالية الداخلية خضراء اللون .
3- أفلاك ( s ) أو أفلاك p.
4- أفلاك d أو أفلاك f .
6- i19k : [Ar] 4s1
i29Cu : [Ar] 3d10 4s1
الفرق بينهما واضح وهو وجود فلك i3d ممتلئ في النحاس وعـدم
وجوده في ذرة البوتاسيوم (عـدم
وجـوده نظريـا لأنه لا يحـوي
إلكترونات حسب مبدأ البناء)
. يترتب على هذا الاختلاف اختلاف
بين في خواص العنصرين الفيزيائية
والكيمائية قارن مثلا:
أ- عدد التأكسد .
ب- نشاط العنصرين كيميائيا .
ج- الكثافة .
د - درجة الانصهار (ودرجة الغليان)
هـ- لون أيون Ca+2 ولون k+1 .
7- إلكترونات الأفلاك الأخيرة تحدد دورة كل منهما
. وجود الإلكترونـات
على فلك s لوحده دون وجود فلك يدل على مجموعة A . أما وجود فلك
d سواء أكان ممتلئا أو غير ممتلئ فيدل على مجموعات
B. وفي حالة
النحاس بما أن فلك i3d10 قد امتلأ فإن عدد الإلكترونات على فلك i4s
يدل على رقم المجموعة B . إذن النحاس من المجموعة B
.
8- في حالة الكالسيوم والخارصين ينطبق الكـلام السابق (7) . ما يمـيز
الخارصين هنا هو أنه يشبه العنصر الممثل Ca في كونه لا يعرف له
سوى رقم أكسدة واحد 2+ أي أنه لا يمنح إلكترونات من فلك i3dالممتلئ .
9- i23V : [Ar] 3d3 4s2
i33As : [Ar] 3d10 4s2 4p3
أ- الدورة الرابعة .
ب- أكبر رقم كم رئيس (أي أعلى مستوى) يحدد الدورة , وأكبر
رقم كم
رئيس هو (4) في حالتي الثاناديوم والزرنيخ .
ج- الثاناديوم : المجموعة VB . والزرنيخ VA .
د- في حالة الثاناديوم مجموع إلكترونات i3d و i4s .
وفي حالة الزرنيخ مجموع الإلكترونات الموجودة على أفلاك i4s و i4s.
هـ- العمودان إلى اليسار لأفلاك s .
الأعمدة الستة في أقصى اليمين لأفلاك p .
الأعمدة العشرة بين أفلاك ( s ) وأفلاك p هي لأفلاك d .
أما فلكي i4f و i5f فنظريا موقعها مع مجموعة III B وبالطبع
لا يمكن وضع 15 عنصرا (14 + اللانثانوم أو الأكتنيسيوم )
في نفس المربع.
بعض الجداول الحديثة مددت الجدول
ووضعت (14) عمودا جديدا
لعناصر i4f و i5f .
5- الخواص المغناطيسية :
|
i22Mn
|
عدد الإلكترونات المنفردة
|
i5
|
|
i22Ti
|
|
i2
|
|
i45Rh
|
|
i3
|
|
i29Cu
|
|
i1
|
|
i48Cd
|
|
صفر |
|
i74W
|
|
i4
|





