|
||||||||||||||
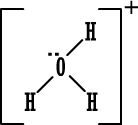
أمثلة على صيغ لويس للأيونات عديدة الذرات ( المجموعات الكيماوية ) .
هذا الأيون مشهور وهو يميز المحاليل المائية للحموض ونحن نعرفه لأنه يلون صبغة عباد الشمس باللون الأحمر ، وهو يعادل أيون الهيدروكسيد القاعدي . لنحدد عدد الكترونات الربط فيه قبل أن نكتب له صيغة لويس .
عدد الكترونات الربط للهيدروجين = ( 1 × 3 ) عدد الكترونات الربط للاكسجين = ( 6 ) . إذن مجموع الكترونات = ( 9 ) .
ولكن الأيون يحمل شحنة موجبة واحدة وهذا معناه أنه فقد الكتروناً واحداً من الكتروناته التسعة ، إذن عدد الكترونات الربط في الأيون ( 8 ) .
أكمل الفراغين بنفسك :
قاعدة الثمانية تنطبق على الأكسجين
قاعدة الثنائي تنطبق على الهيدروجين
لاحظ أن قاعدة الثمانية هي إحدى أشكال قاعدة الثنائي .
|
||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||