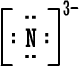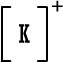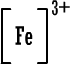|
||||||||||||||||||||||||||||||||||||||||
سادساً : تمثيل لويس للمجموعات الكيميائية
قلنا سابقاً أن ذرة العنصر حينما تكسب أو تفقد الكتروناً ( أو الكترونات ) تتحول إلى أيون سالب أو أيون موجب مثل :
نسمي هذا النوع من الأيونات باسم الأيونات البسيطة إذن الأيون البسيط : هو ذرة واحدة أصبحت مشحونة نتيجة كسبها أو فقدانها لإلكترون واحد أو عدة الكترونات .
يوجد مقابل هذا النوع البسيط من الأيونات أيونات تتكون من عدة ذرات Polyatomic Ions يمكن أن نطلق عليها اسم الأيونات المركبة أو الأيونات عديدة الذرات ، وهذه الأيونات تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة . وأنت ربما تذكر وتعرف بعضاً منها مثل : أيون الهيدرونيوم +[ H3O ] ، أيون الأمونيوم
الشق السالب لمركب كربونات الكالسيوم الموجود في الطبيعة بعديد الأشكال منها الحجر الجيري بأشكاله والطباشير والرخام .
نُسمي هذه الأيونات عديدة الذرات باسم المجموعات الكيماوية وهذه أيونات مركبة بالمقارنة مع الأيونات البسيطة التي تتكون من ذرة واحدة . وهذه الأيونات تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية مع غيرها وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة .
أمثلة على صيغ لويس للأيونات عديدة الذرات ( المجموعات الكيماوية ) . اضغط على المثال لرؤية الحل
|
||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||||||||||||||||||||||||||