|
||||||||||||||
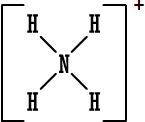
أمثلة على صيغ لويس للأيونات عديدة الذرات ( المجموعات الكيماوية ) .
عدد الكترونات الربط في هذا الأيون = من الهيدروجين 1 × 4 = 4 من النيتروجين 5 × 1 = 5 المجموع = 9
ولكن الأيون يحمل شحنة موجبة واحدة ، إذن هو قد خسر واحدةً من الكتروناته ، إذن عدد الكترونات الربط فيه = 8 .
تنطبق قاعدة الثمانية ( وهي حالة خاصة لقاعدة الثنائي ) على النيتروجين . وقاعدة الثنائي على الهيدروجين.
|
||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||