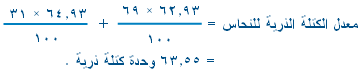|
|||||||||||||
النظائر Isotopes
تتشابه نظائر العنصر الواحد فيما بينها في السلوك الكيميائي ، أي أنها تتفاعل مع غيرها بنفس الطريقة والآلية والسرعة ، ويعود ذلك لتشابهها في العدد الذري والذي يمثل عدد الإلكترونات كما هو يمثل عدد البروتونات ، وأنت تعلم أن التفاعل الكيميائي تشارك فيه الإلكترونات وليس للنواة علاقة به . أما السلوك الفيزيائي لنظائر العنصر الواحد فهو حتماً مختلفة كدرجات الغليان والانصهار والكثافة وغيرها ، ويعود ذلك إلى كتل أنويتها ، فكل نظيرمن نظائر العنصر الواحد يختلف عن سواه في عدد النيوترونات مما يؤدي إلى اختلافها في الكتلة.
حساب معدل الكتلة الذرية للنظائر لحساب معدل الكتلة الذرية للنظائر تضرب الكتلة الذرية لكل نظير في النسبة المئوية لوجوده في الطبيعة ، ثم تجمع معاً لتشكل الكتلة الذرية للعنصر والتي تثبت ككتلة ذرية للعنصر في الجدول الدوري .
مثال : للنحاس نظيران الأول كتلته الذرية 62.93 وحدة كتلة ذرية ونسبة وجوده في الطبيعة 69% ، والكتلة الذرية للثاني 64.93 وحدة كتلة ذرية ونسبة وجوده في الطبيعة 31% .
|
|||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||