|
|
|||||||||
|
إجابات القانون الدوري والجدول الدوري
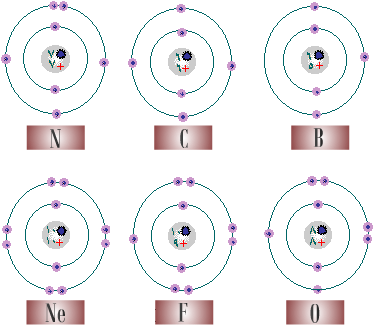
1. لنمثل الآن ذرة عنصر الهيليوم (He) بالرسم ، يمثل الرقم (i2i)
العدد الذري
، اذن يوجد في نواة ذرة الهيليوم
(i2i)
بروتون
، نواة
.
5. ـ لا يمكن ان يكون في الدورة الأولى (المستوى الذري الأول) لماذا ؟ لأن الدورة الأولى تتسع لعنصرين فقط ، أي أن المستوى الأول يتسع إلكترونين .
ـ
لا يمكن ان يكون في الدورة
الثانية (المستوى الذري الثاني)
لماذا ؟
ـ
اذن ستجده في المستوى الثالث،
لماذا ؟
|
|||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||