الإجابة على هذه التساؤلات تكمن في
التركيب الإلكتروني
للعناصر
.
فالغازات النبيلة
توجد على شكل ذرات مستقلة لأن مستوى الطاقة الرئيس الأخير فيها مكتمل
بالإلكترونات ، فلا حاجة لها لفقد أو لكسب الإلكترونات .
ولكن بقية الذرات في الجدول الدوري تمتلك تركيباً الكترونياً مغايراً ، فالبعض منها
يميل
لكسب الإلكترونات
،
والبعض الآخر يميل
لفقد الإلكترونات
سعياً منهما للوصول الى تركيب الكتروني مشابه للتركيب الإلكتروني للغازات
النبيلة المستقرة الكترونياً . ومن هنا تنشأ فكرة ميل الذرات لتكوين روابط كيميائية
بينها أو مع غيرها.
ولتوضيح ذلك أجب عن الأسئلة في التمرين الآتي :
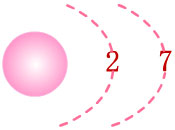
يمتلك الفلور
F
التركيب الإلكتروني الآتي :
|
9F : 1s2
2s2 2p5
|
 |
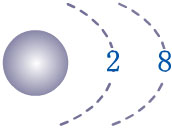
يمتلك النيون
Ne
( غاز نبيل ) التركيب الإلكتروني الآتي :
|
10Ne : 1s2
2s2 2p6
|
 |
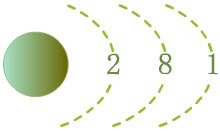
يمتلك الصوديوم
Na
التركيب الإلكتروني الآتي :
|
11Na : 1s2
2s2 2p6 3s1 |
 |
1- أي التراكيب الإلكترونية السابقة أكثر استقراراً ؟
2- كيف يمكن لعنصر الفلور أن يصل الى حالة الإستقرار ؛ عن طريق فقد الإلكترونات أم
عن طريق كسبها ؟
وما عدد الالكترونات التي يفقدها أو يكسبها للوصول الى
حالة الإستقرار ؟
3- كيف يمكن لعنصر الصوديوم أن يصل الى حالة الإستقرار ؛
عن طريق فقد الالكترونات أم عن طريق كسبها ؟
وما عدد الالكترونات التي يفقدها أو يكسبها للوصول الى
حالة الإستقرار ؟
|
1- يعتبر النيون أكثر
التراكيب الإلكترونية السابقة استقراراً، لأن المستوى الأخير فيه
ممتليء بالإلكترونات .
2- يمكن لعنصر الفلور أن يصل الى حالة
الإستقرار
عن طريق
كسب
الكترون واحد ليصبح تركيبه الإلكتروني مشابه للتركيب الإلكتروني لغاز
النيون النبيل .
3- كيف يمكن لعنصر الصوديوم أن يصل الى حالة
الإستقرار
عن طريق
فقد
الكترون واحد ليصبح تركيبه الإلكتروني مشابه للتركيب الإلكتروني لغاز
النيون النبيل . |
|
والآن ما رأيك بالاستنتاج التالي :
ترتبط ذرات العنصر ليصبح تركيبها الإلكتروني أكثر استقراراً ومشابهاً للغاز
النبيل الذي يليه أو يسبقه .
|
 |
| 
