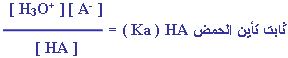|
 الاتزان في
محاليل الحموض الضعيفة
الاتزان في
محاليل الحموض الضعيفة
لو كان لدينا حمض ضعيف صيغته الافتراضية
HA فإنه يمكن تمثيل معادلة تأينه كما يلي :
|
لذلك يمكن التعبير عن ثابت الاتزان كما يلي : |
 |
| |
|
 |
وبما أن [
H2O
] في المحاليل لايتغير بدرجة كبيرة ، فيمكن اعتبار تركيزه قيمة ثابتة
ودمجه في ثابت جديد كما يلي :
يسمى
K
[
H2O
]
ثابت تأين الحمض وسنرمز له بالرمز
Ka
إذاً :
ويوجد لكل حمض من الحموض الضعيفة
قيمة محددة لـ
Ka عند ( 25 ْ س ).
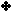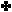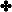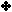 سؤال :
سؤال :
يعتبر
Ka مقياساً لقوة الحمض ( وضح ذلك ) ؟؟.
 سؤال :
سؤال :
إذا علمت أن
Ka
لحمض
HF
=
ه7.1
× 10-4
،
Ka
لحمض
H2CO3
=ه4.2
× 10-7
( عند 25 ْ س )
أجب عما يلي :
1-
أي الحمضين أقوى في محاليل متساوية التركيز لكل منهما ؟
2-
أيهما
]
H3O+
[
فيه أكبر ( محاليل متساوية التركيز ) ؟
3-
أيهما
تكون قيمة
PH له أكبر ( محاليل متساوية التركيز ) ؟
 سؤال
:
سؤال
:
إذا كان لديك محلول
HCl
تركيزه ( 0.1 مول / لتر ) ومحلول حمض
HF
تركيزه ( 0.1 مول / لتر ) . أجب عما يلي :
1-
أيهما يكون
]
H3O+
[
فيه أكبر
( وضح ) ؟
2-
أيهما تكون
PH له أكبر ( وضح ) ؟
والجدول
التالي يوضح ثوابت التأين
Ka
لعدد من الحموض الضعيفة :
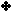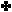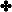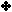 سؤال
:
سؤال
:
بالرجوع للجدول
السابق أجب عما يأتي:
1 - اذكر اسم أقوى الحموض المدرجة في الجدول.
2 - قارن [H3O+]
في محاليل متساوية التركيز من
HNO2
،
HF
،
HCl.
3 - يُعَد
NH4+
حمضاً مفهوم برونستد – لوري. اكتب معادلة تبيّن سلوكه الحمضي في الماء ثم اكتب
تعبير
Ka
له .
4 - هل تتوقع أن تكون
PH
لمحلول
CH3COOH
تركيزه ( 0.1 مول / لتر ) أكثر أم أقل من 2 ؟ ولماذا ؟
|