|
|
|
الترابط بين الجزيئات وحالات المادة |
|
|
|
الحالة الغازية |
قوانين الغازات :
القانون
الرابع
:
2) قانون الغاز المثالي
|
 |
تساوي مقداراً ثابتاً . لقد
أجرى
العلماء اختبارات كثيرة وعلى غازات عديدة فوجدوا أن |
 |
تعرف من البند السابق أن |
لا يساوي
مقداراً ثابتاً .
|
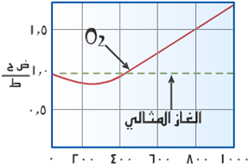 |
ادرس الشكل التالي الذي يربط بين
الضغط
(على المحور السيني)
والمقدار
ض ح /
ط
( على المحور
الصادي )
، من الواضح أن
ض
ح / ط
ليست مقداراً ثابتاً وأنها تشذ كثيراً كلما ازداد
الضغط المطبق على الغاز . ولو درسنا المقدار ض ح /
ط وعلاقته بدرجة الحرارة المطلقة سنجد أن هذا
المقدار أبعد ما يكون عن الثبات خاصةً
عند درجات حرارة منخفضة . |
تختلف الغازات في شذوذها عن قوانين الغازات من نوع لاخر.
فغاز الهيليوم مثلاً يكاد يكون غازاً مثالياً تنطبق عليه
قوانين الغازات في كل الظروف، بينما غاز مثل CO2
وبخار الماء يبتعدان كثيراً جداً عن قوانين
الغازات. ان علينا ان نتذكر إن الكثير من الغازات لا تبقى
في الحالة الغازية عندما نطبق عليها ضغطاً عالياً وعندما
نخفض درجة حرارتها، بل تتحول إلى الحالة السائلة وذلك بسبب
التجاذب بين جزيئاتها.
إذن يمكن أن نقول أن
الغاز
المثالي،
هو
غاز ينطبق عليه قانون بويل
وشارل وقوانين الغازات الأخرى عند جميع
الضغوط ودرجات الحرارة.
أما
الغاز الحقيقي
فهو
غاز ينطبق
عليه قانونا بويل وشارل وقوانين الغازات الأخرى عند درجات
حرارة وضغوط ليست عالية جداً وليست منخفضةً جداً
، أما عند ضغوط عالية ودرجات حرارة منخفضة فيكون
سلوك الغازات شاذاً كثيراً أو قليلاً عن هذه القوانين وذلك
تبعاً لخواص الغاز نفسه .

