|
الفصل الرابع : الحسابات من
المعادلات الكيميائية (1)
15. يحترق الألومنيوم في جو من الأوكسجين مكوناً أوكسيد
الألومنيوم حسب المعادلة :
ولكن كم الكميات اللازمة لحدوث التفاعل وكم كمية المادة
الناتجة ، لمعرفة ذلك يجب موزانة المعادلة ، ويمكن أن نبدأها
|
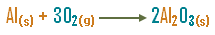 |
بموزانة الأوكسجين فنحصل على :
|
بعد موزانة
الأوكسجين كيف نوازن الألومنيوم ؟ بالضرب في
----
.
نقرأ
المعادلة بعد الموزانة كما يلي ، أكمل الفراغات بوضع الكلمات
المناسبة بنفسك :
تتفاعل أربع
مولات من الألومنيوم مع
----
مولات من جزيئات الأوكسجين وينتج عن ذلك
---- مول من جزيئات أوكسيد الألومنيوم .
|
 |
16. في المعادلة الموزونة : |
إذا تفاعل 8
مول من الألومنيوم فكم مولاً O2 يتفاعل ؟ الجواب: 6
كيف عرفت ؟؟
وكم مولاً
من أوكسيد الألومنيوم ينتج ؟ الجواب :
----
مولات .
|
 |
17. في معادلة احتراق الألومنيوم : |
إذا تفاعل 9 غم من الألومنيوم مع كمية زائدة من الأوكسجين ،
فكم كمية أوكسيد الألومنيوم الناتج ؟
نقرأ من المعادلة أن 4 مول من الألومنيوم (
i4iAl
) تنتج 2 مول من أوكسيد الألومنيوم (i2iAl2O3
) :
|
نذكر هنا بأن الصيغ تكتب بعدد
الجزيئات ( المولات ) ولإجراء الحسابات علينا أن
نحول المولات إلى غرامات . |
كم وزن المول من الألومنيوم ؟ 27 غم .
كم وزن المول من أوكسيد الألومنيوم = ( 2 × 27 غم ) + ( 3 × 16
غم )
= 54 غم + 48 غم
= 102 غم
إذن .....
وزن 2 مول من الأوكسيد = 2 × 102 غم = 204 غم .
وزن 4 مول من الألومنيوم = 4 × 27 = 108 غم .
|
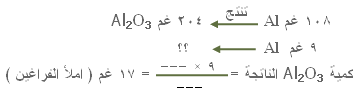 |
إذن .....
|
إجابة السؤال
|