|
قوانين
الديناميكا الحرارية Laws of thermodynamics
المحتوى الحراري أو
الإنثالبي Heat Content or Enthalpy
|
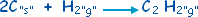 |
مثال :
احسب حرارة التفاعل |
مستخدماً
التفاعلات الثلاثة التالية :
|
 |
ْH
Dهه=
ـ 1299.6
كيلوجول / مول .
|
|
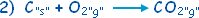 |
ْH
Dه=
ـ 393.5
كيلوجول / مول .
|
|
 |
ْH
D=
ـ 285.9
كيلوجول / مول .
|
الحل :
كيف يمكن الحصول من المعادلات الثلاث على المعادلة المطلوبة ؟
إذا أجبنا على هذا السؤال وصلنا للحل .
نضرب المعادلة
رقم (2) في(2) ، لأن حرارة التفاعل المطلوب تحوي
i2C(s)i
في جانب المواد المتفاعلة ، فتصبح :
|
 |
ْH
Dه=ـ
393.5
× 2
كيلوجول/مول |
|
|
ونجمع
لها المعادلة (3) |
|
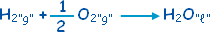 |
ْH
Dه=
ـ 285.9
كيلوجول / مول
|
|
 |
ْH
Dه=
ـ 1073.9
كيلوجول / مول .
|
نعكس المعادلة (1) ونجمعها للمعادلة (4)
|
 |
ْH
Dه=
+ 1299.6 كيلوجول / مول |
|
 |
ْH
Dه=
ـ 1072.9 كيلوجول / مول |
|
بالجمع وبعد حذف المواد
المتشابهة في الطرفين نحصل على المعادلة موضوع السؤال
|
|
 |
ْH
Dه=
+ 226.7 كيلوجول / مول |
هل عرفت الآن لماذا عكسنا المعادلة (1)
؟
|
قانون هس
Hess Law
إن مثالنا السابق
قد حل بناء على قانون وضعه العالم هس ونصه:
إذا تم حصول تفاعل في سلسلة خطوات
، فإن
ْH
D
للتفاعل يساوي مجموع المحتويات الحرارية لهذه
السلسلة من التفاعلات . |
يتضح لنا من قانون هس أنه يمكن جمع
المعادلات الكيميائية حرارياً لذلك يمكن تسميته بقانون الجمع
الحراري .
رجوع
|

