|
قوانين
الديناميكا الحرارية Laws of thermodynamics
المحتوى الحراري أو
الإنثالبي Heat Content or Enthalpy
4- حرارة التشكل (التكون)
النظامية Standard Enthalpies of Formation
عرفنا أن قيمة (
H
) المطلقة لأي مادة أو لأي تغير غير معروفة ، ولذلك فإننا نكتب
دوماً
H
D
، لأن
H
D
يمكن قياسها للتغيرات التي تدرس في المختبرات .
بما أننا نقيس مقدار التغير إذن يجب ان
نحدد نقطة مرجعية تكون مبدأ للقياس ،وقد اتفق العلماء على صفر
افتراضي للمحتوى الحراري لأكثر أشكال العنصر استقراراً
عند الدرجة 25 ْ م وضغط جوي نظامي واحد .
مثال (1) :
المحتوى
الحراري لغاز الهيدروجين عند الدرجة 25 ْم وضغط جوي نظامي واحد
= صفر ( تذكر ان هذا أمر
افتراضي متفق عليه ) .
مثال (2) :
قيس المحتوى الحراري
ْH
D
للتفاعل
|
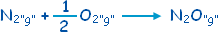 |
ْH
Dه=
81.5
كيلوجول / مول |
فوجد أن |
إن هذا معناه أن تشكل مول واحد من غاز الأوكسيد
N2O
اسمه ثنائي النيتروجين أحادي الأوكسجين من عنصريه يتطلب
81,5 كيلو جول من الطاقة وذلك تحت الشروط النظامية (25 ْم) ,
وضغط جوي نظامي واحد ) .
مثال (3)
:
قيس المحتوى الحراري
ْH
D للتفاعل
|
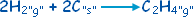 |
ْH
Dه=
52.3
كيلوجول / مول |
فكان |
ومعنى هذا أن تشكل مول واحد من الإيثين
C2H4
يتطلب 52,3 كيلو جول تحت الشروط النظامية .
مثال (4) :
|
 |
للتفاعل =
ـ
680
كيلوجول / مول |
ْH
Dه |
عندما
يتشكل مول واحد من رابع فلوريد الكربون تحت الشروط النظامية
ينتج 680 كيلوجول من الطاقة.
|

