|
قوانين
الديناميكا الحرارية Laws of thermodynamics
القانون الثاني للديناميكا
الحرارية The Second Law of Thermodynamics
حساب التغير في العشوائية
Calculation of Entropy Changes
مثال (1) :
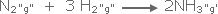 |
احسب
DS◦ لتكوين الأمونيا من عنصريها حسب المعادلة : |
الحل :
مجموع الأنتروبيا للمواد المتفاعلة = (1 × 191.5) + (3 × 130.6)
= 191.5 + 391.8 = 583.3 جول / كلفن
سؤال :
لماذا لم يظهر المول في وحدة قياس
S◦ .
إجابة السؤال
أنتروبيا النواتج = (2 × 192.5) = 385 جول / كلفن
إذن
DS◦
للتفاعل = 385 – 583.3
= - 198.3 جول / كلفن
إن العشوائية سالبة وهذا يدل على أن التفاعل العكسي هو الأقرب لأن
يحدث آنياً تحت هذه الشروط . لاحظ أن نقص العشوائية متوقع فعدد
مولات المواد الغازية المتفاعلة (4) بينما عدد مولات الغازات
الناتجة (2) فقط وعشوائية أربع مولات غازية أكبر من عشوائية
مولين غازيين .
مثال (2) :
تنبأ هل يزيد الأنتروبي أم ينقص لكل تغير من التغيرات التالية في
حال حدوثه تحت الشروط النظامية ، فسِّر جوابك ، وحدِّد أي
التفاعلين الأمامي أم العكسي يمكن أن يحدث تلقائياً . لا تجرِ
أي عمليات حسابية لحساب قيم
DS◦
للتفاعل .
أ- التغير في العشوائية (الأنتروبيا) موجب ، لأن عدد جزيئات النواتج
ثلاثة مقابل جزيء واحد متفاعل ، وأيضاً لوجود جزيئين غازيين في
النواتج ، وكما هو معلوم عشوائية الغازات أعلى بكثير من
عشوائية المواد الصلبة التي تمتاز بنظاميتها .
ب- هنا عدد الجزيئات في الطرفين متساو ، وكلها غازات ، لذلك لا
نستطيع التنبؤ هل تزيد الأنتروبيا أم تنقص ، ولكننا نتوقع أن
تكون قيمة التغير فيها صفراً أو قريباً من الصفر ، باختصار
المعلومات غير كافية للتنبؤ .
ج- التغير في العشوائية سالب . فسِّر الأمر بنفسك .
رجوع
|

