|
قوانين
الديناميكا الحرارية Laws of thermodynamics
القانون الثاني للديناميكا
الحرارية The Second Law of Thermodynamics
طاقة جيبس الحرة أو الطاقة
الحرة Gibbs Free Energy
|
|
لتوضيح أفكار جيبس وما قام به لنأخذ تفاعلاً طارداً للحرارة يجري
تحت ضغط ثابت ، في هذه الحالة تكون كمية الحرارة التي يكتسبها
الجوار (q)
تعطى بالعلاقة :
|
لكن
DS
الكلية =
DS
للجوار +
DS
للنظام
|
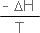 |
وبالتعويض عن
DS
للجوار بما يساويها وهو |
| |
|
|
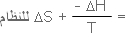 |
وبضرب
طرفي المعادلة في
(T)
TDS
الكلية = -
DH
+
TDS
= - (DH
-
TDS)
ونعلم أنه حتى يكون التغير آنياً يجب أن تكون
DS
الكلية كمية موجبة ، وحتى يتحقق ذلك يجب أن تكون الكمية
DH
-
TDS
كمية سالبة . وبناءً على كل ما سبق أدخل جيبس تابع حالة جديد
(كالأنثالبي والأنتروبي يعتمد على الحالة الابتدائية والحالة
النهائية) أسماه الطاقة الحرة (وسنرمز لها بالرمز
G وهو الحرف الأول من اسم
Gibbs)
وربطها رياضياً كما يلي:
G = H – TS
DG
=
DH
– T
D
S
بأخذ التفاضل ، للطرفين حيث
T
ثابتة
لاحظ أن
T
D
S
الكلية
= -
D
G
إذن حتى يكون التغير آنياً يجب أن تكون
DG
سالبة .
|
|
إن الطاقة الحرة النظامية لتشكل المواد (سنرمز لها
DG◦f)
تربط مع الحالة النظامية للمحتوى الحراري
(DH◦f)
والقصور
الحراري
(DS◦f)
وعلى ذلك فإن علاقة
Gibbs
النظامية هي :
|
وكما هو الحال مع المحتوى الحراري والقصور الحراري فإن الطاقة
الحرة النظامية هي تلك المقاسة عند درجة حرارة
298◦
مطلقة وضغط جوي نظامي . وقد اعتمد العلماء نفس المبدأ الذي
اعتمدوه في قياس المحتوى الحراري وهو اعتبار الطاقة الحرة
النظامية للعنصر = صفراً .
أهمية ومزايا علاقة جيبس
1- أهم ما يميز هذه العلاقة هو أن متغيراتها خاصة بالنظام فقط ولا
تدخل الجوار في العمليات الحسابية مما يجعل أمرها سهلاً .
2- العلاقة تجمع بين المحتوى الحراري والقصور الحراري ودرجة الحرارة
وهي العوامل الأساسية في تحديد الاتجاه الذي يسير فيه التفاعل
.
رجوع
|

