|
الكواشف :
وهي حموض أو
قواعد عضوية يختلف لونها في الحالة الجزيئية عنه في الحالة
الأيونية.
أمثلة الكواشف :
عباد الشمس ،
الميثيل البرتقالي ، الفينولفثالين.
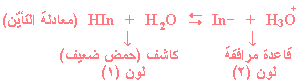
والآن لندرس كاشف (حمض ضعيف) نرمز له بالرمز
HIn ، فعند
تأين الحمض
الضعيف (الكاشف) في الماء يتأين جزيئياً كما
في المعادلة التالية:
وبالطبع يمكن كتابة تعبير ثابت الكاشف والذي سنرمز له (KIn):
[H3O+]ه
[-In]
KIn
=
ــــــــــــــ
[HIn]
وبإعادة ترتيب العلاقة السابقة
Kin
ه [HIn]
[H3O+]ه
=
ــــــــــــــ
[-In]
ملحوظة :
(من العلاقة السابقة)
[HIn]
1 ـ
النسبة بين ــــــ
تعتمد على تركيز[H3O+]
أي على قيمة PH.
[-In]
2 ـ
عند إضافة الكاشف لمحلول حمض (حيث [H3O+]
كبير):
أ- سوف يختل الاتزان في معادلة التأين
للكاشف.
ب- وفقاً لمبدأ لوتشاتلييه سينزاح الاتزان نحو اليسار
فيزداد تركيز [HIn] ويقل تركيز
[-In].
جـ - سيظهر الكاشف بلون HIn
(لون
(1)).
3 ـ
عند إضافة الكاشف لمحلول قاعدي (حيث يقل تركيز [H3O+]):
أ-
سوف يختل الاتزان في معادلة تأيّن الكاشف.
ب- وفقاً لمبدأ لوتشاتلييه سينزاح الاتزان نحو اليمين فيزداد
تركيز [-In]
ويقل تركيز
[HIn].
جـ - سيظهر لو –In
(لون
(2)).
والفكرة ذاتها يمكن
تطبيقها في الكواشف القاعدية. فيمكن أن نرمز لها بالرمز
B
وتكون معادلة التأين:
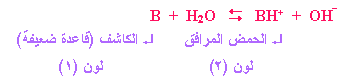
وينطبق التفسير السابق عند إضافة الكاشف
لمحلول حمضي أو محلول قاعدي
.
| 