وبما أن [H2O]
في المحاليل لا
يتغير بدرجة كبيرة، فيمكن اعتبار تركيزه قيمة
ثابتة ودمجه في ثابت جديد كما يلي
:
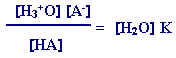
يسمىI[ H2O ] K
ثابت تأين الحمض وسنرمز له بالرمز Ka
إذاًً : ثابت تأيـن الحمض
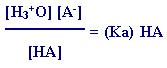
ويوجد لكل حمض من الحموض الضعيفة قيمة محدّدة لِـ
Ka
(عند 525 س).
سؤال :
يُعتبر Ka
مقياساً
لقوة الحمض. (وضحّ ذلك ).
سؤال :
إذا علمت أن Ka
لحمض HF
= ه7.1 × 10-4 ،
وأن Ka
لحمضH2CO3
=
ه4.2 × 10-7 ( عند 525 س )
أجب عما يلي :
1
- أي الحمضين أقوى في محاليل متساوية التركيز لكل منهما
؟
2
- أيّهما يكون [H3O+]
فيه أكبر. (محاليل متساوية التركيز) ؟
3
- أيهما تكون قيمة PH له
أكبر. (محاليل متساوية التركيز)
؟
