|
الاتزان في محاليل القواعد الضعيفة()
|
|
إذا رمزنا لقاعدة ضعيفة
B
فإنه يمكن تمثيل تأين هذه القاعدة في الماء كما يأتي:
B + H2O D BH+ + OH-
وبالطبع
التفاعل عكوس (D ) وبالتالي هنالك حالة اتزان. لذلك يمكن
التعبير عن ثابت الاتزان كما يلي :
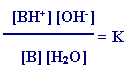
وبما أن [H2O] في المحاليل لا يتغير بدرجة
كبيرة، فيمكن اعتبار تركيزه
قيمة ثابتة، ودمجه في ثابت جديد كما يلي :
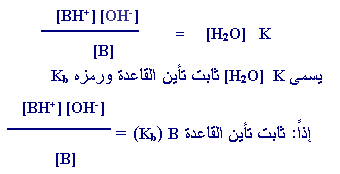
ولذلك يكون لكل قاعدة
من القواعد الضعيفة قيمة محدّدة لِـ Kb
(عند 525
س).
سؤال :
يعتبر Kb
مقياساً لقوة القاعدة (وضّح ذلك).
سؤال :
إذا علمت أن Kb
للقاعدة NH3
= 1.8 × 10- 5
، Kb للقاعدة
N2H4
= 1 × 10-6
(عند 525 س) أجب عما يلي :
1-
أيّهما أقوى كقاعدة.
2-
أيّهما يكون [OH-] فيه أكبر. (لمحاليل متساوية التركيز)
3-
أيّهما يكون [H3O+] فيه أكبر. (لمحاليل متساوية
التركيز)
4-
أيّهما تكون قيمة PH
فيه أكبر. (لمحاليل متساوية التركيز)
سؤال :
إذا كان لديك محلولين متساويين
في التركيز أحدهما KOH والآخر NH3.
أيّهما تكون PH
له أكبر (وضّح) .
|
|
