الحقائق الأساسية لنظرية رابطة التكافؤ
1- تنتج الرابطة عن تداخل فلكين نصف ممتلئين .
2- تتسع منطقة تداخل الفلكين المكونين للرابطة لإلكترونين فقط (يختلفان
عن بعضهما في اتجاه الغزل ) وهما إلكترونا الربط .
3- كلما كانت منطقة تداخل الفلكين أكبر كانت الرابطة الناتجة أقوى
. من الطبيعي إذن أن توجه الذرات نفسها بحيث يحدث أكبر قدر
من التداخل عند تكوين الرابطة يعني التداخل الكبير طول رابطة
أصغر وطاقة أكبر .
4- إن أفلاك الربط حسب هذه النظرية هي أفلاك ذرية , وإن التغير الوحيد
الذي يحصل عليها هو تداخل الواحد منها على الآخر .
الأفلاك المهجنة :
لا تستطيع نظرية رابطة التكافؤ بتصويرها للتداخل بين الأفلاك
الذرية أن تفسر واقع الكثير من التراكيب والبنيات الجزيئية
. لندرس على سبيل المثال المركب المتوقع أن يتكون من اتحاد
الكربون بالهيدروجين ولنحلل الأمر بالخطوات التالية :
اكتب التوزيع الإلكتروني لذرة الكربون :
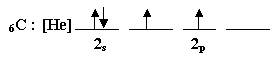
واضح من هذا التوزيع أن عدد الإلكترونات المنفردة في ذرة الكربون
اثنان.
· التوزيع الإلكتروني لذرة الهيدروجين هو i1H : 1s1 وهي تحوي إلكترون
واحد فقط وهو طبعا إلكترون منفرد .
· بناء على ما سبق فإن صيغة المركب المتوقع بين هذين العنصرين هو
CH2 لوجود إلكترونين منفردين في ذرة
الكربون , وعدد الروابط في هذا المركب المتوقع هو رابطتان
.
· ما مقدار زاوية الربط في المركب المتوقع ؟ إنها بالطبع 90 io لأنه يشترك في كل واحدة منها فلك من نوع P .
يمكن أن نصور الجزيء المتوقع حسب بنيات لويس
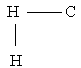
لا يوجد مركب صيغته CH2 في الطبيعة وعندما حاول العلماء إنتاجه مخبريا ظهر
مركب غير مستقر وتحلل بسرعة .
· ما المركب الموجود في الطبيعة بكميات هائلة والذي يتكون
من الكربون والهيدروجين ؟ إنك تعرف هذا المركب منذ عدة سنوات وهو غاز الميثان
CH4
وهو المكون الأكبر للغاز الطبيعي الذي يعرف له الكثير
من الحقول في جميع أنحاء العالم .
· كم عدد الروابط في الميثان ؟ من الواضح أنها أربعة ؟
· ما شكل جزيء الميثان كما ظهر من دراسته في الأشعة السينية ؟ إنه
رباعي الأوجه المنتظم (هرم رباعي منتظم ) وزاوية الربط فيه
o109.5 .
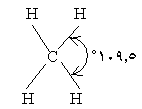
إذن يوجد في ذرة الكربون أربعة إلكترونات منفردة وليس
اثنان كما هو متوقع . كيف نفسر شكل جزيء الميثان رباعي الأوجه
؟ هنا واجه العلماء عدم التوافق بين النظرية والواقع , وبما
أن الوقع هو الأساس وهو الحقيقة , إذن على النظرية أن تعدل
نفسها أو تجد لها مخرجا أو تسقط . لقد وجد العلماء مخرجا لنظرية
رابطة التكافؤ بإدخال مفهوم جديد هو مفهوم الأفلاك المهجنة
التي فسرت الواقع واتفقت معه .
لنرجع إلى مثالنا عن ذرة الكربون , إن توزيعها الإلكتروني :
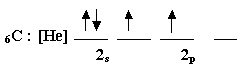
وحتى يصبح عدد الإلكترونات المنفردة فيها أربعة يمكن أن نتهيج
الذرة وتتوزع إلكترونات المستوى الثاني كما يلي :
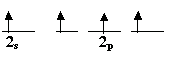
وهنا يمكن للكربون أن يرتبط بأربع ذرات هيدروجين وبأربع روابط
, ولكن هذا لا يتفق مع الواقع , فالروابط
واحدة بين i1s من الهيدروجين و i2s من الكربون , أما الروابط الثلاث الأخرى فهي بين i1s وأفلاك i2p الثلاثة , أي أي الروابط الأربع في الميثان من نوعين
مختلفين, وزوايا الربط غير متساوية , إن الجزيء رباعي الأوجه
وزوايا الربط فيه متساوية إذن الحل أيضا لا يتفق مع الواقع
.
ما دامت الروابط الأربع في الميثان من نوع واحد وزوايا الربط
الأربع متساوية ( o109.5 درجة تقريبا لكل واحدة منها ) فإنه يجب البحث
عن حل يتفق مع هذا الواقع. من الواضح أن هذا الواقع مفاده
أنه يوجد في ذرة الكربون أربعة إلكترونات منفردة وأنها تقع
في أربعة أفلاك متشابهة . لقد وضع العلماء تفسيرا لهذا الأمر
عن طريق تقديم مفهوم جديد هو "تهجين الأفلاك الذرية " , فما
هو التهجين ؟
لنعد إلى التوزيع
الإلكتروني لذرة الكربون في حالتها العادية
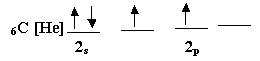
وقد رفعنا أفلاك i2p قليلا إلى أعلى للإشارة إلى أن هناك فرقا صغيرا في الطاقة
بين فلك i2s وأفلاك i2p الثلاثة (وهي متكافئة) . فماذا يحدث لهذه الأفلاك عند
التهجين إنها تمتزج مع بعضها مكونة أفلاك جديدة لها نفس الطاقة
وتتوزع فيها الإلكترونات الأربعة بشكل منفرد ويكون لها نفس
اتجاه الغزل حسب قاعدة هوند , وهذا هو التوزيع حسب الأفلاك
المهجنة :





