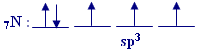|
||||||||||||||||||
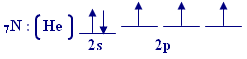
تهجين sp3
:
ج- إذا حدث في
هذه الذرة تهيجياً من نوع
sp3 فاكتب التوزيع للإلكترونات الخارجية بعد التهجين
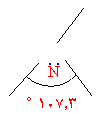
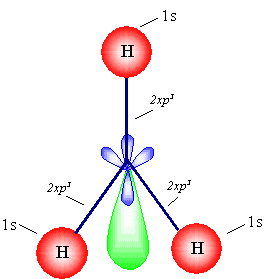
د- يحدث الترابط بين فلك I1s لكل ذرة من ذرات الهيدروجين الثلاث وثلاثة من أفلاك sp3 في ذرة النيتروجين , أما الفلك الرابع فلا يشترك في الربط ( لماذا ؟ ).
|
||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||||