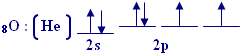 |
|
مزايا الأفلاك
الهجينية |
تهجين sp3
:
دراسة جزيء الماء
H2O
|
الذرة المركزية في الماء هي ذرة الاوكسيجين وتوزيعها الإلكتروني
هو |
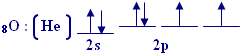 |
|
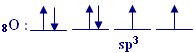
يحدث تهجينsp3 في
هذه الذرة وينتج أربع مدارات هجينة, وهذا هو توزيع الإلكترونات فيها :
يحدث الترابط بين ذرتي الهيدروجين وفلكيsp3
اللذين يحويان الإلكترونين المنفردين, أما الفلكان الآخران فهما
ممتلئين , إذن يوجد في جزء الماء زوجان طليقان من الإلكترونات . يفسر
هذا واقع جزيء الماء وهو زاوي الشكل وزاوية الربط فيه حوالي
104.5 ْ, وهو حالة خاصة أيضاً , أما إذا أخذنا
الزوجين الطليقين بعين الاعتبار فالشكل هو رباعي الأوجه المنتظم لمعرفة
شكل جزيء الماء انظر الشكل التالي .
|
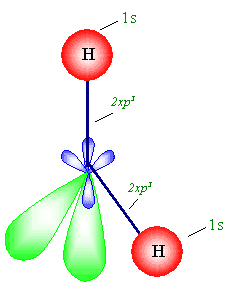 |
من الواضح أن الوابط
من نوع " s
" .
 سؤال
1
: اضرب ثلاثة أمثلة لمركبات
يحدث فيها تهجين
sp3 .
سؤال
1
: اضرب ثلاثة أمثلة لمركبات
يحدث فيها تهجين
sp3 .
ثلاثة أمثلة لمركبات
يحدث فيها تهجين
sp3 :
 سؤال
2
: لماذا تختلف
الزاوية بين مركب وآخر من تلك التي يوجد في ذرتها المركزية
تهجين من نوع
sp3
سؤال
2
: لماذا تختلف
الزاوية بين مركب وآخر من تلك التي يوجد في ذرتها المركزية
تهجين من نوع
sp3
تختلف الزاوية
بين مركب وآخر لواحد من الأسباب التالية أو كلها ( وربما غيرها
) :
أ-
اختلاف طبيعة الذرات المرتبطة .
ب-
دقة جهاز القياس الذي استخدم في قياس الزاوية .
ج- دقة المعلومات والمراجع التي أخذت قيمة الزاوية منها .
د-
وجود أو عدم وجود الأزواج الطليقة في بعض المركبات .