|
قوانين
الديناميكا الحرارية Laws of thermodynamics
القانون الثاني للديناميكا
الحرارية The Second Law of Thermodynamics
القانون الثاني للديناميكا
الحرارية : متى يكون التفاعل آنياً ؟
قد يبدو للوهلة الأولى أن إجابة السؤال متى يكون التفاعل آنياً سهلة
وبديهية ، وأن التغير يكون آنياً إذا كان طارداً للحرارة وغير
آني إذا كان ماصاً لها ، ولكن الحقيقة غير ذلك ، وإذا أعملت
فكرك وتذكرت بعض ما يحدث أمامك من تغيرات آنية تجد فيها ما هو
طارد للحرارة وتجد ما هو ماص لها ، والأمثلة التالية توضح ما
ذكرناه .
|
 |
تغيراً
آني
ماص للطاقة
|
|
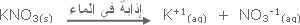 |
|
|
تغير آني ماص للطاقة . |
DH◦
= + 35 kJ/mole |
|
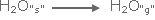 |
|
عملية تسامي
الجليد في فصل الشتاء البارد وهي عملية ماصة للطاقة ولكنها آنية .
ومن التغيرات الآنية الطاردة للطاقة :
|
 |
 تكاثف بخار
الماء
على سطح بارد .
تكاثف بخار
الماء
على سطح بارد . |
|
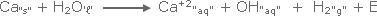 |
 تفاعل فلز الكالسيوم مع
الماء
البارد .
تفاعل فلز الكالسيوم مع
الماء
البارد . |
 تفاعل التعادل بين
محلول
HCl
ومحلول
NaOH
تفاعل التعادل بين
محلول
HCl
ومحلول
NaOH
|
 |
DH◦
= - 56 kJ |
تكون بعض التغيرات
غير آنية عند درجة حرارة المختبر (25 ْم) ولكنها تصبح آنية إذا رفعت
درجة الحرارة ، ومن الأمثلة على ذلك تفاعل المغنيسيوم مع الماء
البارد ، إنه تفاعل غير ملحوظ معادلته هي :
ولكن لو سخن الماء أو بُخِّر وأُمِّرَ على المغنيسيوم يحدث التفاعل
بسرعة .
يتضح مما سبق أن هناك
عوامل
أخرى تؤثر في سير التفاعل غير ما ذكره القانون الأول للديناميكا
الحرارية ، فما هي هذه العوامل ؟ هذه العوامل المؤثرة في سير
التفاعل هي موضوع القانون الثاني من قوانين الديناميكا
الحرارية .
لا شك أنك أدركت أن القانون الثاني يبحث عن العوامل التي تجعل تفاعل
ما آنياً وتجعل تفاعلاً آخر غير آني ، وسنؤجل نص القانون
قليلاً ونضرب أمثلة تطبيقية في البداية لمساعدة الدارس في فهم
القانون وعلاقته بالشغل والآلات التي نستخدمها مثل محركات
السيارات والطائرات ومولدات الكهرباء وغيرها .
|

