3- اما المجموعات B فتقع في وسط الجدول الدوري والمجموعة
الثامنة منها تجمع ثلاث عناصر متجاورة
في كل دورة (Fe , CO
, Ni ) وتعرف باسم الثلاثيات ، تسمى عناصر
مجموعات (B) كلها باسم العناصر الإنتقالية وتضم
ايضا عناصر الدورتين السادسة والسابعة اللتين افرد لهما مكانا خاصا
اسفل الدورة السابعة في الجدول الدوري. ينتمي لعناصر مجموعات B كثير من العناصر المشهورة والمألوفة
لك ومنها ، الفضة ، والخارصين، والكروم، والمنغنيز. حدد المجموعة
التي ينتمي اليها كل عنصر من العناصر الأربعة السابقة.
4- سنكتفي بما تقدم عن مجموعات العناصر الإنتقالية
، وسنقصر دراستنا الآن على بعض عناصر مجموعات
A ولكن قبل متابعة هذه الدراسة يجب
ان نذكر ان تسمية عناصرمجموعات A بالعناصر الممثلة
، وتسمية عناصر المجموعات B بالعناصر الإنتقالية ليست سوى
تسمية اصطلاحية لاغير، ولا تعني ابدا ان عناصر المجموعات
A ارقى من عناصر مجموعات B ان التصنيف A وB هو لغرض التمييز فقط.
5- المستويات الإلكترونية ورسم الذرات : درست
سابقاً أن البروتونات والنيترونات تحتل موقعاً صغيراً في الذرة
اسمه النواة (ما نوع شحنة النواة ؟ ) .أما الإلكترونات فتدور حول النواة في مستويات
متتابعة في البعد عنها ، وتزداد هذه المستويات في طاقتها وحجمها
كلما ابتعدنا عن النواة ويكون أصغرها حجماً وطاقة هو المستوى
الأول الأقرب إلى النواة .
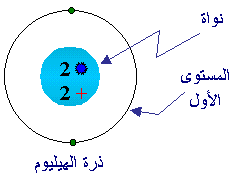
درس العلماء المستويات وما يحتويه كل واحد منها
من الكترونات كما رتبوها من المستوى الأول (1) وهو أقربها إلى النواة
، والمستوى السابع (7) وهو أبعدها عن النواة ، ويوجد هذا المستوى
في عدد قليل من العناصر الثقيلة وأولها عنصر السيزيوم i 87Cs وما يليه من عناصر .
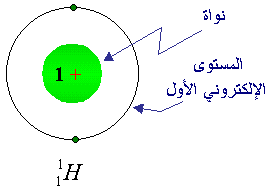
لنأخذ مثالاً بسيطاً على تركيب الذرة وهو عنصر
الهيدروجين ، وهو أخف العناصر على الإطلاق ، لذلك يحتل المربع
الأول في الجدول الدوري وعدده الذري ( 1 ) أي أن نواته تحوي
بروتون واحد ، وتمتاز ذرة الهيدروجين بأنها الوحيدة ، من بين
ذرات العناصر المعروفة كلها ، التي لا يوجد في نواتها نيوترونات
، يوجد مقابل البروتون ـــــــ واحد يعادله . ومن هنا فصاعداً سنستخدم
حرف (p ) (
الصغير ) للدلالة على البروتون
، وحرف ( n ) للدلالة على النيترون ، أما الإلكترون فسنرمز له بالحرف
( e ) أو بكرة صغيرة
( o ) .
إجابات الأسئلة أعلاه :
|
1- أ- IIA
ب- VIA
جـ- VA
3- الفضة IB ، الخارصين
IIB ،
الكروم VIB ، المنغنيز
VIIB
5- بروتون
|
| |
