|
سرعة التفاعل الكيميائي وآلية
التفاعل
نظريات سرعة التفاعل
وآليته
(3
)
|
|
آلية التفاعل :
ب- قانون السرعة للخطوة الأبطأ (خطوة تحديد السرعة ) في آلية التفاعل هي نفسها
التي تقرر سرعة التفاعل الإجمالي كله ، أي أن العلاقة الرياضية
لسرعة التفاعل الإجمالي تقررها خطوة تحديد السرعة .
جـ - نتيجة لما سبق قد نجد أن تركيز
أحد النواتج الانتقالية يظهر في معادلة سرعة التفاعل الإجمالي
وهذا يجب أن لا يحدث لأن المادة الوسطية ليس لها تركيز محدد
فهي تتكون في خطوة ما وتستهلك في خطوة أخرى .
هذا من ناحية ، ومن ناحية أخرى يجب أن يتفق
قانون السرعة مع القانون
الذي اكتشف بالتجربة ، والقانون التجريبي يحوي تراكيز
المواد المتفاعلة التي ثبت أن لها علاقة بقانون السرعة . ما
الحل إذن ؟
الحل
:
أن نجد قيمة تركيزها من معادلة أخرى تدخل فيها إحدى المواد المتفاعلة
في المعادلة الإجمالية ، والمثال التالي يوضح كل ما سبق
.
يتفاعل اليود مع الهيدروجين لتكوين
يوديد الهيدروجين حسب المعادلة الإجمالية :
H2
(g) + I2 (g) ®
2HI(g)I
وقد
وجد تجريبياً أن قانون السرعة لهذا التفاعل هو :
السرعة
= k
×[I2
] × [H2
]
وقد
اقترحت الآلية التالية :
أ-
خطوة سريعة I2 D 2I
ب-
خطوة بطيئة هH2
+ 2I ® 2HI
بما أن خطوة " ب " تحدث ببطء وتعطي المادة الناتجة عن التفاعل
إذن قانون السرعة لهذه الخطوة هو قانون السرعة للتفاعل الإجمالي
، إن قانون السرعة لتفاعل خطوة ب هو : السرعة
= kب × [ H2] ×[ I ]
تحوي هذه المعادلة تركيز اليود
الذري الفعّال وهو تركيز صغير جداً ومتغير ولا يمكن قياسه ،
فإذا عدنا إلى المعادلة المتزنة في خطوة "
أ " فإن ثابت الاتزان لها ونرمز
له بالرمز Kc
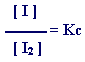
ملاحظة :
ثابت الاتزان لأي تفاعل منعكس = حاصل ضرب
تركيز المواد الناتجة مقسوماً على حاصل ضرب تراكيز المواد المتفاعلة حيث تعتبر
معاملات المواد في المعادلة الموزونة قوى لتراكيزها
.
ومن معادلة ثابت الاتزان نجد أن
[ I ]هI2 =ه Kc × [هI2 ]
فإذا عوضنا هذه القيمة في معادلة السرعة
للخطوة " ب " تصبح :
السرعة = k ب × [H2] ×
Kc
× [I2]
= k
[H2] [I2] حيث
k = kب × kc
=
ثابت .
وهو ما يتفق مع قانون السرعة التجريبي
.
يتضح لنا من هذا المثال
حقيقة هامة وهي أنه إذا اتفق قانون السرعة مع آلية من خطوة واحدة
(كما هو الحال في هذا المثال) فليس
معنى ذلك أن التفاعل الإجمالي يحدث بخطوة واحدة .
لمعرفة الاجابات
اضغط هنا
|
|
