|
|||||||||||||
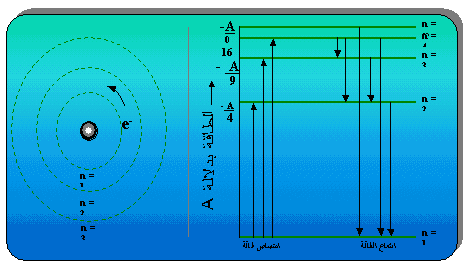
اعتمادا على افكار بلانك واينشتاين ، استطاع العالم بور تفسير طيف ذرة الهيدروجين وحساب طاقة الإلكترون فيها . وهذا هو ملخص نظرية بور على شكل نقاط : 1- هنالك مجموعة محددة من المدارات الدائرية ( مستويات الطاقة ) يدور فيها الكترون ذرة الهيدروجين حول النواة ويمكن التعبير عنها بالارقام 1 ، 2 ، 3 ….إلخ من الأقرب إلى الأبعد عن النواة . 2- ما دام الإلكترون يحتل نفس المدار ولا يغيره فإنه لا يشع ضوءا ( طاقة ) ولا يمتصها. 3- يمكن للإلكترون أن ينتقل من مستوى إلى مستوى آخر بحيث :
|
|||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||