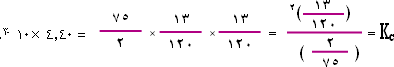مثال (2) :
|
التفاعل التالي في حالة اتزان عند
الدرجة 25 ْم وفي وعاء حجمه 3 لتر، فإذا وجد أن كمية |
NO2 |
= 1.495 غم وان
كمية |
N2O4 |
=7.36 غم |
فاحسب
Kc
لهذا التفاعل.
|
التحليل : من
المعادلة نعلم أن ، |
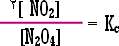 |
إذن
يجب أن نحسب تركيز كل مادة من المادتين، كيف يمكن أن
نحسب تركيز كل مادة ؟
|
هل تعرف أن تركيز
المادة = |
 |
|
نحسب أولاً وزن
المول من |
N2O4 |
=
(2×14) + (4×16) |
| |
|
=
28 + 64
=92 غم. |
|
يمكننا الآن أن نحسب عدد مولات |
N2O4
= |
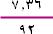 |
=0.08 مولاً . |
|
تركيز |
N2O4
= |
 |
مول / لتر . |
وبطريقة مشابهة نحسب تركيز
NO2
فنجد :
|
وزن المول من
|
NO2
|
=
(1×14)
+ (2×16) |
| |
|
=
14 + 32
=46
غم . |
|
عدد مولات
|
NO2
|
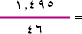 |
=0.325 مول. |
|
تركيز |
NO2
|
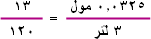 |
مول / لتر . |
والآن لم يبق لنا إلا أن نطبق لنحسب قيمة Kc
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13